济南实验室曹毅教授、薛斌副教授团队在可编程时空力学水凝胶促进干细胞辅助骨再生研究中取得重要进展
近日,济南微生态生物医学省实验室再生医学及组织工程微制造平台曹毅教授,薛斌副教授团队联合南京大学附属鼓楼医院蒋青团队,针对骨干细胞移植骨再生领域内的应用痛点,依据干细胞力刺激响应基础研究成果,创造性地利用液-液相分离软模板设计策略,开发了一种可编程时空力学信号的大孔水凝胶,通过调控干细胞的力学微环境促进骨组织再生,为干细胞辅助骨缺损修复提供了新策略。本研究以《可编程时空力学水凝胶促进干细胞辅助骨再生》(Hydrogels with programmed spatiotemporal mechanical cues for stem cell-assisted bone regeneration)为题在《自然通讯》(Nature Communications)(IF:15.7,中科院一区TOP期刊)杂志发表重要成果。

骨缺损是一类常见且严重的临床问题,尤其是大面积或复杂骨缺损,不仅影响患者生活质量,还会导致长期功能障碍,给个人和社会带来沉重负担。因此,亟需安全高效的修复策略来促进骨组织再生。干细胞由于具备多向分化潜能和免疫调节作用,被广泛认为是骨组织工程的理想种子细胞。然而,干细胞在移植后的存活、归巢及分化效率仍受限于缺损部位的微环境支持。如何精确调控干细胞的行为以提升骨修复效果,成为该领域的核心挑战。
骨组织是一个高度力学依赖性的结构,其再生过程不仅需要适宜的生化信号,还需要合理的力学刺激来引导细胞增殖与分化。大量研究表明,材料的力学特性变化(包括刚度、弹性和降解过程)会直接影响干细胞的命运决策。理想的骨修复支架应在时空尺度上同时满足力学支撑与组织生长的协调,从而实现最佳的再生效果。
为解决这一难题,本研究团队开发了基于大孔水凝胶材料的基质弹性与干细胞分化去耦合的技术流程,并将其应用在干细胞移植案例中,解决了骨组织修复细胞增殖和定性分化难以同时满足的难点,提升了干细胞移植骨修复的性能指标,形成了仿生大孔凝胶硬组织修复技术体系,为干细胞移植组织修复的进步一转化应用提供了材料和力学耦合的技术线路。
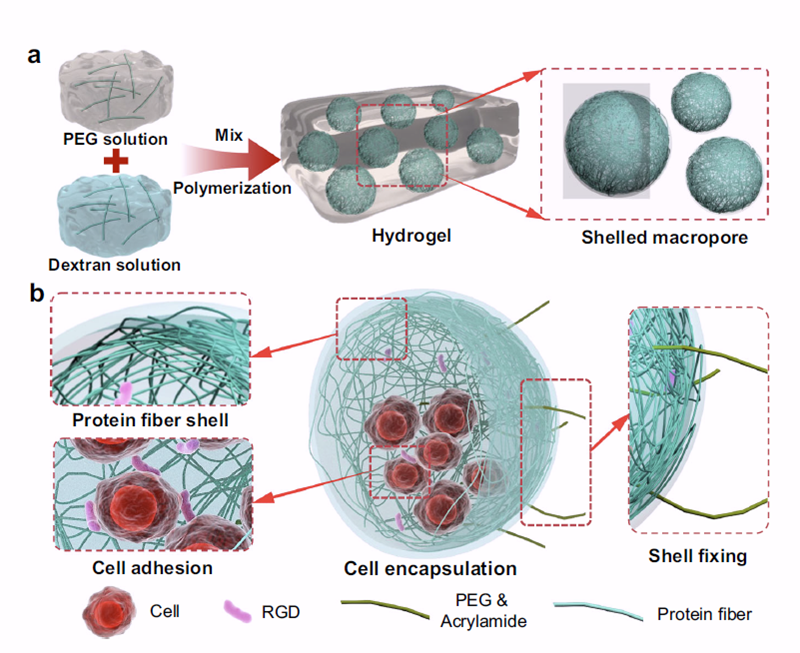
该水凝胶系统由三个核心模块构成:首先,通过液–液相分离策略构建大孔结构,为细胞渗入和组织长入提供通道;其次,在孔壁形成由蛋白纳米纤维构成的壳硬化结构,提供持续的力学支撑与刺激;最后,通过调节可降解与不可降解高分子组分比例,实现水凝胶刚度与降解过程的时空可控,使其与骨组织生成的节奏匹配。
在兔和猪的大段骨缺损模型中,该可编程力学水凝胶与干细胞协同作用,显著提升了新骨形成的体积、厚度和质量,而单独使用水凝胶或干细胞均难以达到同等修复效果。这一策略为骨缺损治疗提供了一种高效、可控且具临床转化潜力的新型材料解决方案。
科研启发
本研究构建了一种具有可编程时空力学信号的大孔水凝胶体系,实现了对干细胞力学微环境的精准调控,从而高效促进骨组织再生。这种结合时空可控力学刺激与组织工程支架的策略,不仅为骨缺损修复提供了新思路,也为开发适用于其他力学依赖性组织(如软骨、肌腱等)的再生材料设计提供了重要参考。
济南微生态生物医学省实验室薛斌副教授为该论文的共同第一作者,实验室曹毅教授、薛斌副教授为该论文共同通讯作者,顾晓松院士与实验室副主任江春平教授团队所在的微生态新技术中心参与了该成果相关内容的研究。该研究工作得到了济南微生态生物医学省实验室研究项目(项目号:JNL-2025008B, JNL-2025009B、JNL-2025010B)和山东省实验室项目(项目号:SYS202202)的支持。