李新钢教授、陈安静研究员在胶质瘤RNA/DNA结合蛋白研究领域取得新进展
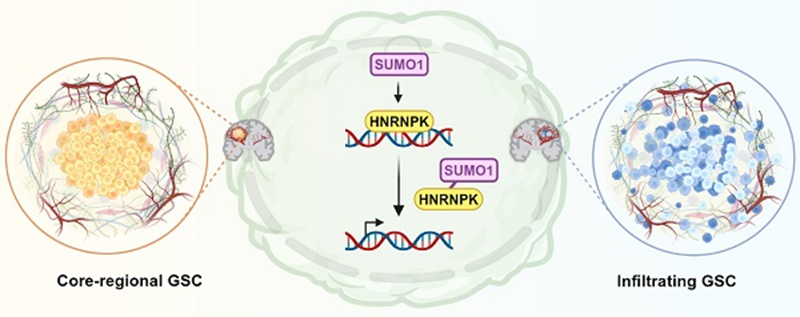
近期,济南微生态生物医学省实验室副主任李新钢教授和陈安静研究员团队在国际生物学科学杂志《International Journal of Biological Sciences》(中科院1区Top,IF=8.2)发表了题为“SUMOylation modification of HNRNPK at the K422 site promotes invasion in glioblastoma”。本研究揭示脑胶质瘤RNA/DNA结合蛋白(RBPs)HNRNPK在K422位点的SUMO化修饰会干扰其DNA结合能力,从而破坏下游转录调控功能,最终导致胶质母细胞瘤干细胞(Glioblastoma stem cell,GSC)转化为前神经元亚型(PN型),并促进肿瘤侵袭。

脑胶质瘤作为成人颅内恶性肿瘤,致残、致死率极高,其中胶质母细胞瘤(Glioblastoma,GBM)是恶性程度最高的胶质瘤。GBM肿瘤具有高度的异质性,不同细胞类型适应其周围环境并经历转变的能力,显著增加了GBM的研究和治疗复杂性,这也是GBM临床治疗效果不佳的主要原因。团队致力于鉴定并深刻影响GBM发生、发展的关键 RNA/DNA结合蛋白(RBPs),为GBM的理解和治疗提供新的策略。
蛋白质SUMO化修饰(SUMOylation)是一种精细的翻译后修饰方式,在细胞周期调控、细胞代谢、基因转录等众多细胞生物学过程中发挥着重要作用,这一过程密切调控肿瘤进展、转移以及治疗抵抗等关键过程。论文团队针对这一领域内的关键科学问题,依托于高通量测序技术和单细胞分析,利用磷酸化蛋白芯片、表面等离子共振(SPR)等技术手段,独创多色荧光三维重建与侵袭深度分析,结合体内动物模型,开展了深入的研究。
在GBM中,我们发现,RBPs蛋白HNRNPK的SUMO化修饰被发现在肿瘤微血管增殖区域高度表达,并倾向于在神经祖细胞样(NPC-like)肿瘤细胞中表达。HNRNPK-SUMO1表达主要在GBM浸润区域发现。HNRNPK的K422残基的SUMO化修饰干扰了其DNA结合能力,从而破坏了下游转录,最终导致胶质母细胞瘤干细胞状态之间的转换。这一发现为GBM的治疗提供了新的分子靶点,可能通过调节HNRNPK的SUMO化修饰状态来抑制GBM细胞的侵袭能力,对于开发新的GBM治疗手段具有重要的临床意义。
科研启发
团队围绕脑胶质瘤RBPs研究领域前期已发表Clinical Cancer Research、Theranostics等多篇代表性文章。本研究强调了RBPs及其SUMO化修饰在肿瘤微环境中的动态调控潜力,为开发针对肿瘤细胞状态转变的精准治疗策略提供了重要启示,也为癌症靶向治疗的创新研究提供了理论支持。
本研究得到了国家自然科学基金面上项目(82472932)、山东省泰山学者工程(tsqn201909173)、山东省重大基础研究(ZR2022ZD36)以及济南微生态生物医学省实验室项目(JNL2023007C和JNL-2022003A)的资助。